丙烯酰胺的单体结构
丙烯酰胺的单体结构中含有碳与碳原子间的不饱和结构,碳与杂原子间的不饱和结构,其结构式如下: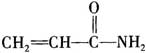
丙烯酰胺的单体分子中取代基只有一个-NH2,并且-NH2取代基半径较小,与碳原子间的不饱和结构不对称,所以不论取代基程度如何都能进行聚合,复合离子聚丙烯酰胺如果在引发剂的作用下聚合反应可以瞬间发生。丙烯酰胺的单体极性
丙烯酰胺的单体分子中引入-NH2极性取代基团后,国内聚丙烯酰胺生产中存在的问题和国外的差别形成了非对称性CH2CHCONH2型化合物偶极矩,由于双键的极化作用,单体分子的聚合能力显著提高。
但是,在丙烯酰胺的单体分子中,碳基化合物>C=0<中取代基的影响与>C=C<中的不同,因为羰基本身就是极性基团,若在其碳原子上引入-NH2极性取代基将会降低单体分子的极性,从而使聚合能力降低。丙烯酰胺单体分子内部的共轭状部分
丙烯酰胺的单体分子中双键上的电子与酰胺基上的电子形成共轭体系,使得双键上的电子云密度降低,复合离子聚丙烯酰胺因此容易打开,单体分子很活泼,不易聚合。
引发剂Cu2O与二价铁盐构成了氧化-还原体系,分解产生初级游离基,初级游离基与丙烯酰胺单体结合形成的丙烯酰胺单体游离基。步骤如下:第一步,Cu2O分解成初级游离基。
第二步,初级游离基具有很高的反应活性,它与单体分子反应生成带有一个电子的单体游离基(Cu在端上)。
Cu+CH2=CHCONH2→CuCH2-CHCONH2
由于Cu2O分解是吸热反应,反应速率较小,却是控制聚合反应的主要一步。而初级游离基Cu与丙烯酰胺单体结合生成的单体游离基是放热反应,复合离子聚丙烯酰胺反应极易进行,反应速率也较大。丙烯酰胺自由基聚合
聚丙烯酰胺是由丙烯酰胺经自由基聚合而得,国内聚丙烯酰胺生产中存在的问题和国外的差别其所形成的结构链式为: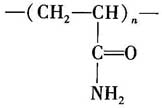
式中,n的范围可从几到400000。
它可以利用各种辐射,光(可见光和紫外线),超声波,电流或在聚合条件下易分解的化合物引发聚合。聚丙烯酰胺链结构为线性大分子,在商业上,常把含有50%以上的丙烯酰胺共聚物命名为PAM。
工业上常用易分解成自由基的化合物,是含有-O-O-键的过氧化物和含C-N键的偶氮化物,聚丙烯酰胺,pam,阴离子聚丙烯酰胺,非离子聚丙烯酰胺,阳离子聚丙烯酰胺--巩义市泰和水处理材料有限公司如K2S2O8,(NH4)2S2O8,H2O2等无机过氧化物,过氧化苯甲酰等有机过氧化物,偶氮二异丁氰,偶氮双氰基戊酸钠等偶氮化合物。在过氧化物中,也常采用加入少量还原剂如FeSO4,NaHSO3,FeCl2等双组分氧化-还原体系后组成的氧化-还原引发体系。
自由基聚合反应的全过程一般由链引发,链增长和链终止3步基元反应组成。此外,伴有不同程度的链转移反应。丙烯酰胺在引发剂作用下进行自由基聚合得高相对分子质量的聚丙烯酰胺的过程遵从聚合反应机理,各基元反应如下。
(1)链引发。
形成自由基的反应,称为引发反应。引发剂及热能,光能,辐射能均可以使单体生成单体自由基。用引发剂时,链引发包含两步反应。
①引发剂I均裂,形成一对初级自由基R·: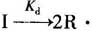
式中,Kd是引发剂分解的速率常数,例如: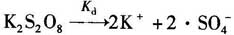
②初级自由基R·与单体加成,生成单体自由基: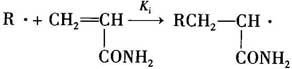
式中Ki-引发速率常数。
单体自由基形成以后,继续与其他单体加聚,就进入链增长阶段。
(2)链增长。
链引发产生的单体自由基不断地和单体分子结合生成链自由基,如此反复的过程称为链增长反应,其反应过程如下: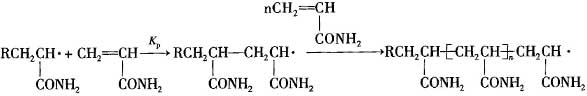
式中Kp--链增长速率常数。
链增长反应非常迅速,Kp值在1*10^4L/(mol·s)范围内链增长活化能较低,为21-23kJ/mol,所以链增长速率极高。单体自由基在极短时间内就可以结合上千甚至上万个单体生成聚合物链自由基,而后终止成大分子。因此在反应混合物中几乎只由单体和聚合物两部分组成。链增长反应是放热反应,丙烯酰胺聚合热为82.8kJ/mol。
聚合物的结构决定于链增长反应。在增长过程中,链自由基与单体的结合方式有两种: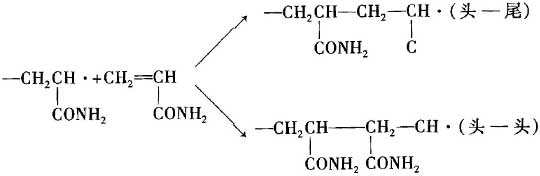
红外光谱,核磁共振分析和化学测定的结果表明,在自由基聚合反应中主要得到头-尾结合排列。产生头-尾结构的原因,有电子效应和位阻效应两个方面:
①按头-尾连接时,自由基上的独电子与取代基构成共轭,使生成的自由基较稳定;
但按头-头(尾-尾)连接时,无共轭效应,生成的自由基不稳定。因此,生成的高分子链主要按头-尾方式结合。
②按头-尾方式结合时的空间位阻要比头-头(尾-尾)方式小,故有利于头-尾结合。
自由基聚合时,大分子链虽以头-尾结构为主,但不能做到序列结构上的绝对规整。从立体结构看,按自由基聚合制得的大分子链取代基在空间结构的排布是无规的。
(3)链终止。
链自由基失去活性形成稳定聚合物分子的反应为链终止反应。链终止和链增长是一对竞争反应。链终止与体系中自由基浓度有关。要得到足够相对分子质量高的产物,保持体系中低自由基浓度是非常重要的。
(4)链转移。
在自由基聚合反应中,除了链引发,链增长,链终止3步基元反应外,往往伴有链转移反应。所谓链转移反应,即一个增长着的链自由基从其他分子上夺取一个原子,而终止成为稳定的大分子。其他分子可以是单体,引发剂,溶剂或特殊的链转移剂。链转移发生后使原来的自由基终止,聚合度因而减小,另外形成一个自由基。若新的自由基有足够活性,可进一步引发单体链转移,然后继续增长。水溶液中丙烯酰胺聚合的链转移常数见表2-3。水溶液中丙烯酰胺聚合的链转移常数 表2-3 链转移种类温度(℃)链转移常数(*10^4)单体250.0786±0.0107单体401.0120±0.0328聚合物<50忽略H2O25接近零H2O2255K2S2O8254.12±2.38K2S2O84026.3±7.08HSO3-751700CH3OH300.13(CH3)2CHOH5019铁盐25很高铜盐25很高丙烯酰胺的聚合动力学
丙烯酰胺及其他不饱和胺的聚合动力学取决于温度,介质的pH值,所用溶剂的性质,以及在反应体系中是否存在复合剂,表面活性剂,链转移剂及其他因素。(1)聚合速率。
丙烯酰胺水溶液的聚合反应速率Rp与单体,引发剂浓度有如下关系:
Rp=0.108[K2S2O8]0.5[M]1.25
聚合反应主要因比例失衡而终止。像无机盐,表面活性剂,络合剂及有机溶剂可以提高或减慢聚合速率,从而改变聚合动力学。如在低温和极低引发剂浓度的条件下聚合,就能获得4*10^7的相对分子质量。对于大多数工业应用来说,较低一些的相对分子质量就足够了。
可以添加链转移剂来控制相对分子质量和防止链与链之间的交联。一般用2-丙醇控制相对分子质量的大小。
聚合速率通常正比于引发剂浓度的平方根。聚合速率正比于单体浓度的1.2-1.5次幂。关于pH值,温度对丙烯酰胺聚合速率的影响见表2-4和表2-5。水溶液中AM的聚合参数 表2-4 温度(℃)pHKp·10^-4L/(mol·s)
Kt·10^-4L/(mol·s)Kp/Kt^0.5 L/^0.5(mol·s)0.5250.11.814.54.2251.01.7±0.316.3±0.74.3±0.2255.50.6±0.13.3±0.63.3±0.325130.4±0.11.0±0.24.0±0.519-0.8±0.45.5±0.43.53077.9±0.5660.0±403.35133.21502.619134.31703.330135.82004.1注:Kp为链增长速率常数;Kt为链终止速率常数。
表2-4可见,丙烯酰胺在25℃,pH=0.1的水溶液中进行聚合反应时,链增长速率常数Kp为1.8x10^4/(mol·s),链终止速率常数Kt为1.45*10^4/L/(mol·s);在25℃,pH=1时增长速率常数Kp为(1.7±0.3)*10^4L(mol·s)。比率Kp/Kt0.5几乎与pH值无关,总是等于4.2±0.2,该比值很大。与其他单体的聚合反应相比。丙烯酰胺比率Kp/Kt非常大,这就意味着每一次引发聚合的单体分子数比其他单体要大得多。这也说明,这种单体的聚合反应迅速,得到的聚合物相对分子质量高。丙烯酰胺,甲基丙烯酰胺,N,N-二甲基丙烯酰胺的聚合参数 表2-5 单体和pH值温度(℃)Kp*10^-4(L/(mol·s))Kt*10^-6(L/(mol·s))Kp/Kt0.5(L0.5/(mol·s)0.5)丙烯酰胺,pH=75.57.96003.219.09.47203.529.711.79003.9酸性介质10.50.0611.90.16甲基丙烯酰胺15.00.6512.90.1825.00.0816.50.2039.50.1023.10.21酸性介质50.01.119.04.0N,N-二甲丙烯酰胺注:Kp为链增长速率常数;Kt为链终止速率常数。
由表2-5同时可见,在酸性溶液中要比在碱性溶液中的链增长速率常数大得多,因此聚合速率也随之快得多。但由于Kp与Kt0.5的比值甚为接近,所以分子链长(或相对分子质量)与pH值关系不大。
聚合的动力参数明显依赖于介质的pH值。pH值影响聚合速率的原因,可能是由于溶液中氢离子浓度不同时引发速率不同。因而已知一种广泛使用的引发剂过硫酸钾,在酸性溶液里比在中性或碱性介质里的分解速率高得多。改变pH值会改变引发速率,因而也就改变了用过氧化氢及各种氧化-还原剂引发的速率。
AM聚合时,介质的pH值不仅影响反应动力学还影响高分子的结构和性质。在较低pH值时聚合易伴生分子内和分子间的酰亚胺化反应,形成支链或交联性产物。在较高pH值下,单体分子或聚合物分子中的酰胺基(-CONH2)会发生水解反应,使均聚物改变成含有羧基的共聚物。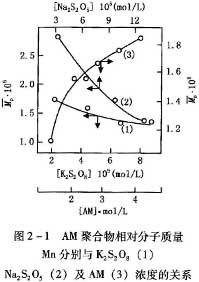
(2)聚合物相对分子质量。
靠自由基聚合的聚合物相对分子质量受一系列因素的影响。其中最显著的有链引发速率和链增长速率之比,链终止方式,向单体的链转移反应,以及溶剂,引发剂,各种杂质和专门加入的添加剂。聚合物相对分子质量随单体浓度升高和引发剂浓度降低而升高,这点从图2-1可见。
研究了在过硫酸盐-亚硫酸氢盐氧化-还原体系下,Cu2+和Fe2+离子联合及分别对AM聚合的影响.结果表明,随着Cu2+和Fe2+离子浓度的升高,聚丙烯酰胺聚合加快,相对分子质量(Mp)降低,Cu2+的这些影响更为显著。已经证明,引入螯合剂,取金属离子4倍量的乙二胺四乙酸钠盐,可以消除这些金属离子对聚合作用的不利影响。
AM水溶液聚合中添加无机盐或表面活性剂可影响聚合过程。如Fe3+盐的链转移常数为4.2*10^4,它可大幅度改变产物的相对分子质量。存在痕量的金属离子都会干扰引发体系,引起过早聚合而降低相对分子质量。所以聚合物生产用的聚合装置忌用铁器,聚合容器要用不锈刚制成或内壁衬聚四氟乙烯,并可靠抽空或通氮气除氧同时要求AM单体纯度很高。在过硫酸盐-亚硫酸氢盐的引发体系中,碱性添加剂(NaOH,Na2CO3)对AM聚合有影响。当溶液转向碱性时,聚合体系发生变化。在碱性环境内发生负反应,其机理如下:S2O28- + S2O25- + OH- →2SO24- + S2O24- + H+
提高Na2COC浓度会降低聚合速率(其量级为0.1),提高相对分子质量。这可能是由于方程中的负反应消耗引发剂,降低了自由基浓度。
与Na2CO3相反,加入NaOH会大大降低聚合速率(量级为-0.8)及相对分子质量。观察到的NaOH影响是在聚合环境中形成TCA(即氮氚三丙烯酰胺),接着TCA参加链转移反应,降低聚合物的相对分子质量。AM在碱性介质中聚合,酰胺水解生成氮氚三丙烯酰胺并作为链转移剂,导致生成的PAM可溶。
利用KUO法对PAM相对分子质量的分布数据进行处理时得出,74.6%的大分子是由于再结合作用使大基团链终止制得,只有25.4%的大分子是由歧化作用和链转移制得的。AM的链转移常数Cm见表2-6。AM水溶液聚合的链转移常数Cm 表2-6 温度(℃)Cm(*10^5)温度(℃)Cm(*10^5)184.4306.8250.8401.2251.2501.5251.6501.0252.0606.0252.0601.2257.8表2-6中可以看出,大部分AM水溶液在25℃时,PAM的最大可能平均相对分子质量Mp值在(350-900)*10^4之间。升高温度会使链转移常数增大,平均相对分子质量Mp值减小。在AM水溶液聚合,50℃以下时活性增大,链向水和聚合物分子的链转移多,而向引发剂和单体的链转移少,据文献资料报道,PAM的相对分子质量Mp值可达(200-400)*10^4。产生这种差异可能有几个原因。应注意的一点是,对于高分子聚合物通常测定Mw(重均相对分子质最)或Mn(数均相对分子质量),而Mw和Mn的数位比Mp大。聚合物的相对分子质量分布越宽这种差别越大。另一方面,少部分交联或歧化的反应促使聚合度分散性增大,其结果是高分子成分的百分比较高。
在一定的聚合或干燥条件下会形成亚胺化交联(方程(1)和方程(2))。部分亚胺化的聚合物水溶性降低。分子间的亚胺化使聚合物完全交联而不溶,分子内的交联仅会部分不溶。可以调节溶液中单体浓度,改变溶液pH值,控制反应温度,采用水溶性链转移剂来控制相对分子质量和亚胺化程度。AM在酸性介质中聚合,产物难溶或不溶。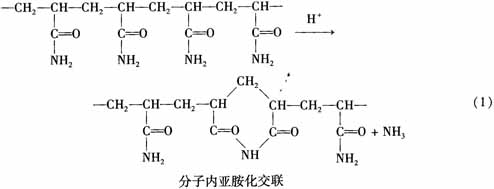
因此,非离子聚丙烯酰胺链结构并非全部为线性直链大分子,它的高分子链结构中包含支链和亚胺化交联的结构。交联合适则相对分子质量高,可溶;交联多则不溶。可利用在聚合溶液中加入尿素,削弱PAM链间缔合,防止不溶交联物产生从而提高PAM相对分子质量。尿素相对分子质量小,有加快大分子溶解速度以制备易溶PAM产品等作用。
近年来,高相对分子质童特别是超高相对分子质量PAM产品的研究与开发,在国内外引起了极大关注。这是因为油田驱油用的聚合物PAM用量很大,其驱油效力一般随相对分子质量的增高而增高。一般聚合物相对分子质量随单体浓度升高而增大,随着引发速度加快而减小。
因此为提高聚丙烯酰胺相对分子质量,从利用聚合反应规律方面考虑,适当增大单体浓度,减少引发剂浓度,降低聚合反应温度;或从聚合引发体系方面考虑,采用由甲基丙烯酸N,N-二甲胺基乙酯(DMAEMA)和常规引发剂组成的,具有引发和参与聚合的双重功能引发体系,例如MAEMA+K2S2O8或K2S2O8-DMAEMA-NaHSO3,就能制得相对分子质量高,水溶性好的产品。在聚合分子中引入庞大侧基,带电荷基团,缔合或微交联也可以提高相对分子质量,提高聚合物的黏度及附温抗盐性能。例如用N,N'-二甲基丙烯酰胺(DMAM),2-丙烯酰胺基-2-甲基丙磺酸(AMPS),丙烯酰胺(AM)共聚合成了具有较好耐温,抗盐性和增黏性的驱油用的AM/DMAM/AMPS三元共聚物。
各种因素对聚合反应的影响程度
丙烯酰胺的聚合动力学取决于温度,介质的pH值,所用溶剂的性质以及反应体系中是否存在复合剂,表面活性剂,链转移剂及其他因素。由于催化剂体系及反应条件在实验室阶段已设定,工业化生产时,可控制的反应条件只有反应液浓度及温度,催化剂加入量和时间,吹氮操作,pH值等。
(1)单体纯度及引发剂浓度。根据聚合速率与引发剂浓度的1/2及单体浓度成正比例。引发剂受热分解成初级自由基,但被杂质终止,无高聚物生成。实验证明,非常纯净的单体聚合时可以没有诱导期。缩短诱导期的主要途径是除净杂质。
(2)氧含量。氧是强阻聚剂,它与自由基反应生成不活泼的过氧自由基:Mx+O2→Mx-O-O
消耗了大量的引发剂,导致链引发速率降低,诱导时间长。一般是由于氧含量过高造成的反应异常,现象反应曲线如图2-2所示。
从图2-2可以看出,反应升温总体较慢,没有明显的分段,终温较低,物料不成胶或成胶后料黏。
(3)聚合温度。氧化-还原体系引发剂可在0-5℃左右开始,而偶氮类引发剂需要在30℃左右引发。所以反应初期是氧化-还原体系在起引发作用,一旦温度超过30℃左右,基本上可以保证反应速率。实际生产中也验证了这一点,从反应曲线上一般可以判断问题出在哪一个环节。图2-3是实际生产中出现反应异常的曲线。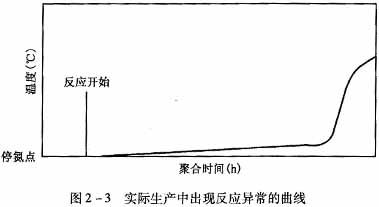
由图2-3可见,反应初期氧化还原反应较慢,后期偶氮引发使反应速度加快。这种反应周期一般不会超过12h,虽然反应时间长,但一般不会出现稀料,出料基本正常。
(4)聚合介质的pH值。通过实验数据,聚合的动力学参数明县依赖于介质的pH值,pH值影响聚合速率的原因可能是由于溶液中氢离子浓度不同时引发速率不同。改变pH值
则改变引发速率,因而也就改变了各种氧化-还原剂引发的速率。而在较低pH值时,聚合易伴生分子内和分子间的酸亚胺化反应,形成支链或交联性产物,同时反应速度快,影响黏度指标。一般由于反应液pH值过高造成,见图2-4。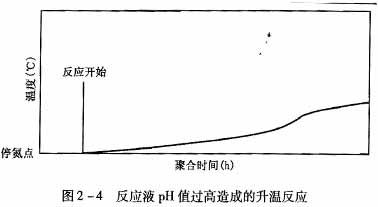
由图2-4可见,诱导时间长,一段反应升温慢,二段引发拐点不太明显,反应周期一般在24-48h,终温不理想,反应胶体表面较硬,内部由于反应不完全故呈稀汤状。
(5)副反应对引发率的影响。Cu2O引发剂分解后引发率特别低,主要原因是一些副反应使某些初级游离基不能形成单体游离基。
例如:①初级游离基Cu与引发剂Cu2O作用发生诱导分解。
Cu+Cu1-Cu2→Cu-Cu2+Cu1
②初级游离基与溶剂分子发生链转移。
Cu+HCl→CuCl2+2H
③初级游离基之间发生偶合反应。
2Cu→Cu一Cu
④初级游离基与氧或杂质反应,生成稳定性大的游离基。
Cu+O2→Cu-O-O-Cu
在①,④的反应中④Cu-O-O属于不活泼游离基,不能引发单体聚合,而只能与另一游离基结合形成过氧化物。因此,在化工生产中氧是最常见的阻聚剂。
Cu-O-O+Cu→Cu-O-OCu
(6)链转移对聚丙烯酰胺相对分子质量的影响。聚丙烯酰胺的聚合度减少,相对分子质量降低,主要是受丙烯酰胺的单体纯度和杂质的影响。在丙烯酰胺的单体水溶液中,若含有丙烯酸(AA),N-三丙酰胺(NTPA),-羟基丙腈(ECH),羟基丙酰胺(HPA),丙酰胺,Cu,Fe等有机物和无机物,就会使丙烯酰胺的单体聚合反应中,伴随有链转移反应的发生,活性链就会向这些杂质转移,原来的游离基终止,结果使得聚合度减少,相对分子质量降低。
在实际生产中,生产合格的丙烯酰胺(50%)单体溶液,必须进行精制,过滤,严格控制温度和pH值等各项指标,见表2-7。丙烯酰胺产品控制指标和范围 表2-7 指标范围AAA(%)48-51色度,号≤10pH值6-7Cu(*10^-3mg/L)<100硫脲TU(mg/L)5-15Fe(mg/L)≤0.1AN(mg/L)<50NTPA(mg/L)≤100ECH(MG/L)≤1000



